Das Aus für Augmentation mit KEM plus Stammzellen?
Erstmals stand ein minimalinvasives und praxistaugliches Verfahren zur Knochenaugmentation mit körpereigenen Stammzellen zur Verfügung, das den aktuellen Goldstandard – das autologe Transplantat – in vielen Fällen hätte ablösen können. Doch gesetzliche Reglementierungen scheinen den Durchbruch zu stoppen. An der Universität Freiburg, die federführend in der Anwendung war, kommt das Verfahren jedenfalls nicht mehr zum Einsatz. Was sind die Gründe?
„Jetzt sind wir wieder zurück im Mittelalter, wir entnehmen Knochenblöckchen wie vor 50 Jahren“, sagte Prof. Dr. Dr. Rainer Schmelzeisen, Ärztlicher Direktor der Klinik für Mund-, Kiefer- und Gesichtschirurgie an der Universität Freiburg, ein wenig resigniert.
Dabei hatte alles so vielversprechend angefangen. Schmelzeisen und sein Team hatten sich bereits vor fast zehn Jahren der Idee gewidmet, Knochentransplantationen im Kiefer-/Gesichtsbereich für Patienten nebenwirkungsärmer und schmerzfreier zu gestalten sowie insbesondere Zweiteingriffe mit der bekannten zusätzlichen Morbidität zu vermeiden. Während bis heute die Entnahme von Knochenblöcken und Beckenkammspongiosa als State of the Art gilt, hatte die Arbeitsgruppe Schmelzeisen und Dr. Dr. Sebastian Sauerbier frühzeitig eine im Bereich der Orthopädie und der Herzchirurgie etablierte Methode, das sogenannte BMAC-Verfahren, angewendet und wissenschaftlich untersucht. Schmelzeisen: „Es handelte sich um ein Chairside-Verfahren, das uns ermöglicht, innerhalb von 30 Minuten patienteneigene Stammzellen zu gewinnen. Die Methode hat sich außerordentlich bewährt, wir haben das als Doppelblindstudie durchführen können.“
Für die Patienten bedeutete die Therapie einen bedeutsamen Schritt von der schmerzhaften Spongiosa-Gewinnung mit dem Trepan zu einer nadelgestützten Blutentnahme vom Beckenkamm mit Aufbereitung der Zellen durch Zentrifuga‧tion, wie Schmelzeisen betont. Er und sein Team waren jedenfalls froh, endlich ein Verfahren gefunden zu haben, das in der Klinik funktionierte. Doch das ist nun Vergangenheit. Schmelzeisen: „Im Moment ist unser Interesse zwangsläufig etwas erlahmt. Die gesetzlichen Vorgaben erlauben es zurzeit nicht, dieses Verfahren ohne Herstellererlaubnis chairside im OP durchzuführen. Letztlich hängt das wohl auch mit der Änderung des Aggregatzustands der Zellen durch Zentrifugieren zusammen. Der Gesetzgeber vertritt dazu die Auffassung, dass durch das Zentrifugieren eine essenzielle Zustandsänderung eintritt“, erläutert Schmelzeisen. Doch das ist nicht der einzige Grund.
Das Paul-Ehrlich-Institut (PEI) stuft BMAC-Präparate zur Geweberegeneration zudem als eine non-homologe Anwendung ein. Die Präparate fallen daher in Deutschland unter die Definition der Arzneimittel für neuartige Therapien (ATMP, Advanced Therapy Medicinal Products). Für die Herstellung solcher Präparate ist eine Erlaubnis nach § 13 AMG notwendig; eine Entnahme des Knochenmarks erfordert eine Erlaubnis nach § 20b AMG.
Verboten ist das Verfahren damit nicht, weder in Freiburg noch anderswo, wie die Recherchen des DENTAL MAGAZINs bei unterschiedlichen Landesbehörden ergaben. Aber das Interesse der Kliniken dürfte wie in Freiburg „etwas erlahmen“, wenn ein Chairside-Verfahren nicht mehr praktikabel erscheint. Denn: Auch für die Herstellung von BMAC-Produkten, die nicht in Verkehr gebracht werden, muss eine Herstellungserlaubnis nach § 13 AMG vorliegen, „da es sich wegen des Einsatzes zur Geweberegeneration um ein ATMP handelt“, wie das Paul-Ehrlich-Institut auf Anfrage des DENTAL MAGAZINs antwortet. Ob alle Bundesländer der Stellungnahme folgen? Davon ist auszugehen. Denn die deutschen Landesbehörden stimmen sich bei der Einstufung von Verfahren und Präparaten in der Regel mit dem PEI ab, weiß man im Regierungspräsidium Freiburg. Zitat: „Es ist daher davon auszugehen, dass auch andere Landesbehörden den meldenden Einrichtungen vergleichbare Einstufungen mitteilen werden; damit gelten die entsprechenden Erlaubnispflichten nach § 20b AMG (Gewebeentnahme) und § 13 AMG (Herstellung).“
Mit der vorgeschriebenen Herstellungserlaubnis auch für die Chairside-Anwendung rückt die ursprünglich angedachte Anwendung dieser Methode auch in der niedergelassenen Praxis in weite Ferne. Ob in Baden-Württemberg (Freiburg, Stuttgart), Bayern, Niedersachsen, Hessen oder Rheinland-Pfalz – überall gilt: Das Verfahren wird nicht untersagt, die Herstellererlaubnis aber ist ein Muss. Angesichts der immensen Dokumentationspflicht läutete das in Freiburg das Aus dieses Verfahrens ein.
Schmelzeisen ergriff im Mai dieses Jahres noch einmal die Initiative, um die Verantwortlichen beim Paul-Ehrlich-Institut von den Vorteilen der Therapie für den Patienten zu überzeugen. Ein Antwortschreiben hat er bis heute nicht erhalten.
Die Hoffnung, dass die Bestimmungen neu interpretiert werden, hegt er dennoch. Und ein Hoffnungsschimmer bleibt tatsächlich: Denn die European Medicines Agency (EMA) stuft das BMAC-Verfahren nicht als ATMP ein. Dazu sein Kollege Sauerbier: „Es ist medizinisches Allgemeingut, dass die Zellen aus dem Knochenmark an der Frakturheilung und Knochenbildung maßgeblich beteiligt sind. Deshalb ist die Einstufung als non-homologe Anwendung nicht nachzuvollziehen. Es wäre wünschenswert, dass das Paul Ehrlich Institut der Einschätzung der EMA folgt.“
Bone Marrow Aspirate Concentrate (BMAC)
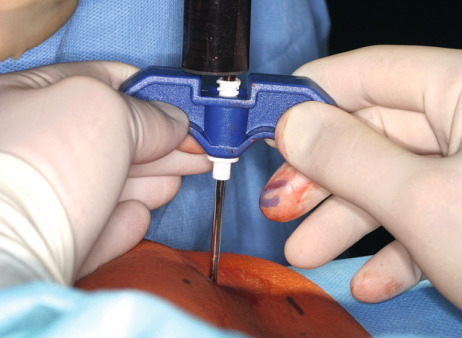
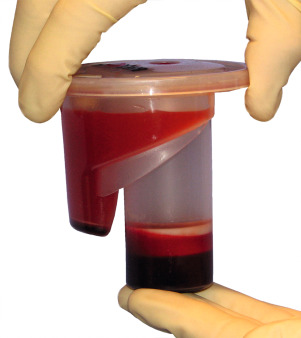
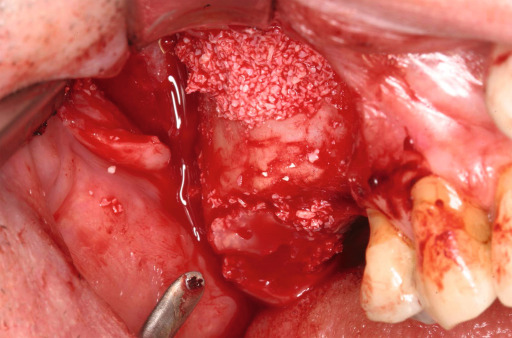
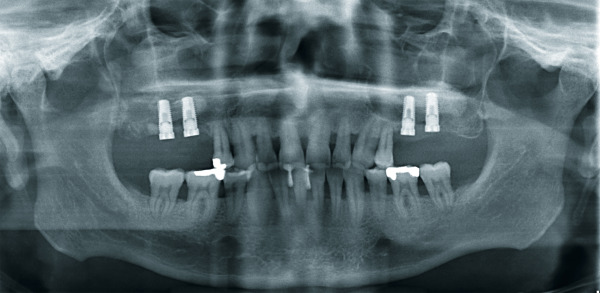
Atrophierte Kieferkammbereiche erschweren Implantantinsertionen im ortsständigen Knochen. Um Knochen aufzubauen, stehen dem Behandler verschiedene Methoden und Materialien zur Verfügung, die die Situation verbessern, z. B. die gesteuerte Knochenregeneration, die Onlay-Technik oder die Distraktionsosteogenese. Bei der Therapie komplexer Fälle ist der autologe Knochen aufgrund der osteogenen, osteokonduktiven und osteoinduktiven Eigenschaften Goldstandard. Spenderareale für den körpereigenen Knochen sind meist Kinn, Becken oder der retromolare Bereich. Die Hebung eines Transplantats ist invasiv, ggf. schmerzhaft und langwierig. Zudem drohen Wundheilungsstörungen und andere Komplikationen. Das Unternehmen Harvest Technologies, USA, stellte eine Zentrifugentechnik bereit, die es ermöglicht, Zellkonzentrat aus Knochenmark zu gewinnen. Knochenmark enthält die für die Regenera‧tion von Geweben notwendigen mesenchymalen Stamm- und Progenitorzellen sowie natürliche Wachstumsfaktoren, die zusammen für die Regeneration von Weich- und Hartgewebe notwendig sind. Zweiteingriffe und damit verbundene mögliche Komplikationen entfallen: Zur Entnahme kann in Lokalanästhesie oder Sedierung am Beckenkamm (dorsal oder ventral) punktiert und etwa 60 ml Knochenmark können aspiriert werden. Die aus dem Knochenmark gewonnenen Zellen werden in der Chairside-Sitzung konzentriert. Die Zentrifugation selbst dauert 14 Minuten. Dabei werden 3 bis 7 ml Zellkonzentrat gewonnen. Anschließend wird es mit rein autologem Thrombin, das in derselben Sitzung parallel gewonnen wird, vermischt. Mit dem Konzentrat wird eine Trägersubstanz (Knochenersatzmaterial) beimpft und an die vorgesehene Stelle appliziert. Der erste Sinuslift mit Biomaterial (BioOss) und Stammzellen aus dem Knochenmark an einem Patienten wurde um 2005 in der Freiburger Klinik für Mund-, Kiefer- und Gesichtschirurgie durchgeführt. An einer multizentrischen Studie haben neben Freiburg (Prof. Dr. Dr. Rainer Schmelzeisen) die Universitäten Mainz (Prof. Dr. Dr. Wilfried Wagner) und Groningen/Niederlande (Dr. Gerry M. Raghoebar) mitgearbeitet. In Deutschland nutzten 2009 etwa ein Dutzend Implantologen das Verfahren. Wegen der Beckenpunktion blieb es in erster Linie Kieferchirurgen vorbehalten. Dr. Petra G. Rauch MSc. (DGI) aus Melsungen war damals eine der ersten Niedergelassenen, die das Stammzellverfahren im Kieferbereich einsetzten und begeistert waren von den neuen Möglichkeiten (DENTAL MAGAZIN 2009). Auch der Oralchirurg Dr. Dr. Jens Kuschnierz aus Offenburg zählte zu den Pionieren dieser Technik.