Diese Mundspüllösungen wirken gegen Corona und den Biofilm
„Infektionsschutz und Biofilmkontrolle – was leisten Mundspüllösungen?“ Das war das Thema eines Roundtable-Gesprächs mit Fachleuten der Medizin und Zahnmedizin. Auf Einladung des DENTAL MAGAZINs und des international agierenden Forschungsunternehmens Dentaid diskutierten Experten die Evidenz antiseptischer Wirkstoffe sowie Wirkstoffkombinationen (PERIO AID Active Control) und gaben konkrete Handlungsempfehlungen für den Infektionsschutz und das Biofilmmanagement.

Was bringt das Gurgeln und Spülen mit Mundspüllösungen gegen das neuartige Coronavirus und den Biofilm? Ein Roundtable-Gespräch liefert Antworten. © romanets_v – stock.adobe.com
Teilnehmer waren der Virologe Dr. Dieter Hoffmann, Stellvertretender Leiter des Instituts für Virologie der Technischen Universität München, Dr. Lena Katharina Müller, wissenschaftliche Mitarbeiterin der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universität Mainz, PD Dr. Fabian Cieplik, Oberarzt an der Poliklinik für Zahnerhaltung und Parodontologie des Universitätsklinikums Regensburg, Prof. Dr. Nicole Arweiler, Direktorin der Klinik für Parodontologie und periimplantäre Erkrankungen des UKGM der Philipps-Universität Marburg, Prof. Dr. Dirk Ziebolz, Oberarzt für Zahnerhaltung und Parodontologie am Universitätsklinikum Leipzig, und die Dentalhygienikerin Sylvia Fresmann, Vorsitzende der Deutschen Gesellschaft für Dentalhygieniker/Innen e.V. (DGDH), Dülmen. Sie besprachen, wie effektiv Mundspüllösungen neben der Biofilmkontrolle auch gegen Corona wirken.
Mundspüllösungen sind heute aus Praxis und Alltag nicht mehr wegzudenken – bei verschiedenen Indikationen ist das chemische Biofilmmanagement kurz- oder längerfristig indiziert. Im Rahmen der Corona-Pandemie rücken Mundspüllösungen hinsichtlich des Infektionsschutzes in Praxen, aber auch in der Öffentlichkeit, in den Fokus.
Mundspüllösungen reduzieren Viruslast von Corona
Dass eine Mundspülung bzw. das Gurgeln mit Schleimhautantiseptika kurz vor einer zahnärztlichen Behandlung (preprocedural rinsing) Vorteile hinsichtlich der Reduktion der bakteriellen Keimzahl bringt, stand für die Experten außer Frage. Zudem könnte es zur Infektionsprophylaxe gegen viele Pathogene beitragen. Entsprechend sollte das Spülen bzw. Gurgeln – wie in der S1-Leitlinie zu Aerosolen in der Zahnarztpraxis beschrieben [DGZMK Sept. 2020, AWMF 083–046] – vor jeder Behandlung für 30 bis 60 Sekunden durchgeführt werden, vertrat die Runde unisono.
Zwar sind weitere klinische Studien nötig, eine In-vivo-Untersuchung legt jedoch nahe, dass bestimmte Wirkstoffe, die bereits in vitro die Viruslast senkten, auch eine potenzielle SARS-CoV-2-Viruskonzentration im Rachen- und Mundraum und somit im Spraynebel und Aerosol kurzfristig vermindern könnten. Daher empfiehlt auch die Deutsche Gesellschaft für Krankenhaushygiene (DGKH) „viruzides Gurgeln“ als simple zusätzliche Maßnahme im Rahmen der Corona-Pandemie [DGKH 2020]. Doch zu welchen konkreten Substanzen verdichtet sich die Evidenz?
Aerosol ≠ Spraynebel/Spraynebelrückprall Hintergrund: Kühlwasser pro Minute für hoch- und höchsttourige Präparationsinstrumente 50 ml/Minute
Bei durchschnittlich 0,35 ml Speichelflussrate/Minute bzw. im Schnitt 106 Viruskopien/ml im Speichel einer infektiösen Person: 20.000 Viruskopien/ml vs. 350.000 Viruskopien/ml Spraynebel Aerosol (beispielhafte Rechnung anhand von Durchschnittswerten). [Kimmel 2020, Zhou 2020]© Naeblys – stock.adobe.com
SARS-CoV-2-Virus: Charakteristika und Infektiosität
Der Virologe Hoffmann skizzierte zum Auftakt die Hauptübertragungswege und Charakteristika des SARS-CoV-2-Virus. SARS-CoV-2 werde hauptsächlich durch Tröpfchen und Aerosole übertragen. Die Infektiosität gehe dabei von Nase, Mund und Rachen aus. Speichelproben seien zum Teil sogar nachweislich sensitiver als Nasen- und Rachenabstriche. Und selbst in Speicheldrüsen sei die Viruslast belegt [Wyllie et al. 2020]. Im Vergleich zu Influenzaviren sind SARS-CoV-2-Viren leichter übertragbar und nicht streng saisonal, wie Hoffmann betonte. Die Inkubationszeit betrage fünf bis sieben Tage, 50 bis 80 Prozent der Betroffenen blieben symptomfrei.
Ein wichtiger Punkt auch hinsichtlich benötigter In-vivo-Studien zur Wirksamkeit von Mundspüllösungen gegen SARS-CoV-2 seien die Testverfahren. Viruslasten werden überwiegend durch real-time PCR (RT-PCR) gemessen. Dabei werden virale Genomkopien quantifiziert. Infektiöse Viren könnten nur durch Anzucht in Zellkultur nachgewiesen werden, ein Verfahren, das nicht zur Routinediagnostik geeignet sei. Bestrebungen seien daher im Gange, die Viruslast als Marker für Infektiosität zu standardisieren. Für klinische Wirksamkeitsstudien benötige man Patienten mit hoher Viruslast. Allerdings sind Viruslasten – z. B. in Nasen-/Rachenabstrichen oder im Speichel – nur Momentaufnahmen, die sich rasch ändern können. Antikörpernachweise im Blut können sinnvoll ergänzen: „Sind Antikörper nachweisbar, ist der Patient meist nicht mehr infektiös“, erklärt der Virologe.
Zahlreiche Studien zur Wirkung von Mundspüllösungen gegen Corona
Inzwischen gibt es zahlreiche aktuelle In-vitro-Studien zur Wirksamkeit von Mundspüllösungen gegen Corona. Das Spektrum der getesteten Wirkstoffe reicht von Chlorhexidin (CHX) über Cetylpyridiniumchlorid (CPC), CHX-CPC-Kombinationen bis hin zu grünem Tee. Das Ergebnis: Einige Wirkstoffe können das Virus in vitro inaktivieren [Meister et al. 2020, Burton et al. 2020, Carrouel et al. 2020]. In eigenen Untersuchungen konnte Hoffmann auch in vivo eine Reduktion der Viruslast im Nasen-Rachenraum durch Zähneputzen feststellen. Somit spiele auch die mechanische Komponente eine Rolle.
Vor dem Betreten der Praxis gilt es,
- Risiken zu minimieren (Triage)
- Risikogruppen zu schützen (separieren).
Beim Betreten der Praxis gilt es,
- die Distanzregeln einzuhalten
- einen Mund-Nasen-Schutz (MNS) zu tragen:
- Patienten gemäß den jeweiligen Regelungen in den Bundesländern bis zum Beginn der Behandlung und im Anschluss daran
- Angestellte dauerhaft, auch außerhalb des Behandlungszimmers
- Visiere bieten nur eine zusätzliche Sicherheit, reichen allein aber nicht.
Maßnahmen während der Behandlung
- MNS nach Risiko: bei Patienten ohne Infektionsverdacht mindestens medizinischer MNS, bei Patienten mit Infektionsverdacht FFP-2, z. B. im Rahmen von SARS-CoV-2
- Pre-Rinse: Kurz vor der Behandlung sollten Patienten für 30-60 Sekunden spülen bzw. richtig gurgeln (siehe Tabelle). Dies könnte kurzfristig eine potenzielle Viruskonzentration im Rachen- und Mundraum und somit im Spraynebel und Aerosol vermindern.
- Konsequente und hochvolumige Spraynebelabsaugung mit einer durchmesseroptimierten Saugkanüle (Speichelzieher nicht ausreichend!), auch bei PZR
- Rotierende und schwingende Instrumente benötigen eine Kühleinheit und sind nach Risikoabwägung ggf. zu vermeiden
- Nach Möglichkeit Anlegen eines Kofferdams
- Stoßlüften nach jeder Behandlung ist natürlich ein Muss.
Quelle: DGZMK 2020, S1-Leitlinie Aerosolübertragbare Erreger
CPC verringert in vitro Infektiosität und RNA-Last
Speziell der in Mundspülungen enthaltene Wirkstoff CPC verringere nachweislich sowohl die SARS-CoV-2-Infektiosität in vitro als auch die RNA-Last (Ribonukleinsäure-Last), sagt Hoffmann [Carrouel et al. 2020, Muñoz-Basagoiti et al. 2020]. Wichtig: Mit der Mundspülung sollte mit zurückgelegtem Kopf intensiv gegurgelt werden, um den Rachenraum möglichst gut zu erfassen. Denn: Speichel aus dem hinteren Oropharynx repräsentiert ein Kompartiment des Respirationstrakts mit meist höherer SARS-CoV-2-Replikation als in Speicheldrüsen [Azzi et al. 2021]. Hoffmann: „Wenn man den Rachenraum gurgelt, hat man das Maximale getan.“
Leitlinie Aerosole, eine „Living Guideline“
Zu diesem Ergebnis kommt auch die S1-Leitlinie zu Aerosolen (Umgang mit zahnmedizinischen Patienten bei Belastung mit Aerosolübertragbaren Erregern, AWMF-Registernummer: 083–046, Stand: September 2020, Gültig bis: März 2021). Es handelt sich um eine „Living Guideline“, wie Müller, eine der federführenden Autorinnen, betont. Die Leitlinie muss kontinuierlich überarbeitet und der aktuellen Situation angepasst werden. Sie stehe da im ständigen Austausch mit ihrem „Chef“, dem Direktor der Klinik für Mund-, Kiefer- und Gesichtschirurgie, plastische Operationen, Prof. Dr. Dr. Bilal Al-Nawas, der die Leitlinie koordiniere. „Ostern 2020 habe ich begonnen zu schreiben, einen Monat später war alles anders“, berichtet sie. Die neue überarbeitete Leitlinienversion wird Anfang März veröffentlicht.
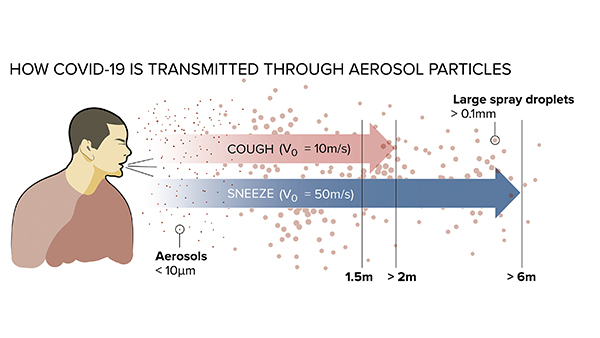
Nicht geändert haben sich dagegen die Definitionen von Spraynebel, Tröpfchen und Aerosolen:
- Tröpfchen, die beim Sprechen entstehen, haben eine Größe von 1 bis 10 µm.
- Aerosol beträgt weniger als 5 µm.
- Spraynebel ist nicht identisch mit Aerosolen, sondern entsteht vor allem beim Einsatz hochtouriger Instrumente. Um Schäden im Pulpa-Dentin-Bereich zu vermeiden, ist eine wirksame Kühlung mit Wasser nötig. Dabei entsteht Spraynebel, der aus Spritzern und Tröpfchen besteht, die unter anderem Kühlwasser, Blut, Speichel und vor allem auch Mikroorganismen enthalten. Wird der Spraynebel nicht fachgerecht im Mund des Patienten abgesaugt, bilden sich auch Aerosole, die infektiöse Erreger enthalten können. Diese Aerosolwolke kann tatsächlich über mehrere Stunden in einem geschlossenen Raum verbleiben, wenn nicht für genug Luftaustausch gesorgt ist.
Der überwiegende Anteil des Spraynebel-Rückpralls besteht aus Tröpfchen (≥ 10 µm). Rund 90 Prozent der größeren Partikel des zahnmedizinischen Spraynebels (20 µm) fallen auf das Gesicht oder die Körperoberfläche des Patienten.
Mundspüllösungen deaktivieren Coronavirus
Zu Beginn der Pandemie wurde in Europa häufig H2O2 empfohlen. Neuere Untersuchungen der Effektivität einer 1%igen Wasserstoffperoxid-Mundspülung (30s) auf die intraorale Viruslast von Gottsauner, Cieplik und Kollegen fielen aber ernüchternd aus. Die Viruslast reduzierte sich nicht [Gottsauner et al. 2020]. Deshalb wird H2O2 als Wirkstoff in der aktualisierten Living Guideline „Aerosole“ gestrichen.
CPC scheint im Gegensatz zu CHX in vitro effektiver gegen SARS-CoV-2 zu wirken. So bescheinigte auch Cieplik quartären Ammoniumverbindungen wie CPC und BAC in vitro eine hohe antivirale Effektivität gegenüber SARS-CoV-2 [Meister et al. 2020, Statkute et al. 2020]. Das spanische virologische Institut IrsiCaixa zeigte, dass die im Labor erreichte 1000-fache Reduktion der Viruslast in der Formulierung 0,12 % CHX und 0,05 % CPC eindeutig dem Anteil an CPC zugeordnet werden kann.
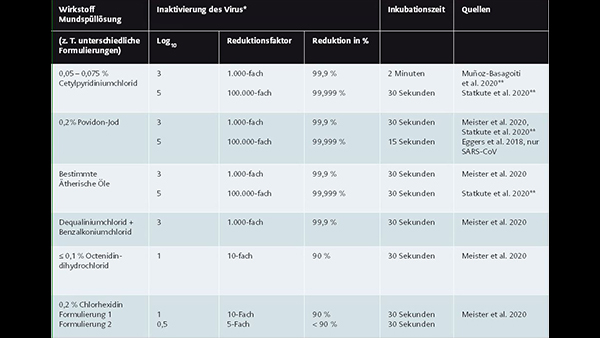
Aktuelle In-vitro-Evidenz der Wirkstoffe in Mundspüllösungen (SARS-CoV-2 bzw. SARS-CoV)
* Je nach Virenstamm kann diese Zahl nach unten abweichen. ** Preprints
Den Studien zufolge greifen quartäre Ammoniumverbindungen wie CPC die Hülle des SARS-CoV-2-Virus an [O’Donnell et al. 2020, Muñoz-Basagoiti et al. 2020]. Die membranzerstörende Wirkung, speziell des Wirkstoffs CPC, zeigte Müller auch am Beispiel von Influenza-Viren [Popkin et al. 2017]. Die RNA sei zwar noch vorhanden, das Virus aber deaktiviert.
Signifikante Reduktion der Viruslast
Eine Translation dieser Ergebnisse in die Klinik sei nicht ohne Weiteres möglich. Müller stellte jedoch eine In-vivo-Untersuchung zur Wirksamkeit von Mundspüllösungen gegen das Corona-Virus vor [Seneviratne et al. 2020]. SARS-CoV-2-positive Probanden wurden in vier Gruppen eingeteilt: CHX (n=6), CPC (n=4), Povidon-Jod (n=4) und Wasser (n=2). Die Evidenz sei zwar aufgrund der wenigen Probanden gering, die Ergebnisse aber aufschlussreich. Die Viruslast wurde fünf Minuten, drei und sechs Stunden nach dem Spülen mittels Speichelprobe und RT-PCR getestet. Eine signifikante Reduktion der Viruslast zeigten CPC (nach 5 min und 6 h) und Povidon-Jod (6 h). Genauere Rückschlüsse über die klinische Effektivität von CPC gegenüber SARS-CoV-2 können aber nur durch Viruskultivierung gezogen werden. Daher brauche es in neuen Studien andere Testverfahren als RT-PCR, um klinische relevante Effekte einer Mundspülung mit CPC zu untersuchen.
Müller fasste zusammen: „Auch für Mund-Nasen-Schutz versus FFP2-Masken gibt es bisher überwiegend In-vitro-Daten, schließlich leben wir erst seit einem Jahr in dieser Situation. Wichtig ist es, alle möglichen Maßnahmen zu kombinieren, um die Hygienekette in der Praxis aufrechtzuerhalten.“
Wirkungsmechanismen CHX und CPC
Cieplik gab einen biochemischen Überblick über das Bisbiguanid-Derivat CHX, das in Mundspülungen meist in Konzentrationen von 0,05 % bis 0,2 % eingesetzt wird, und die quartäre Ammoniumverbindung CPC, deren Konzentration zwischen 0,05 und 0,075 % liegt. Die Wirkstoffe werden auch kombiniert, z. B. in PERIO AID Active Control mit 0,05 % CHX und 0,05 % CPC. Während die Wirkungsmechanismen beider Moleküle auf die Zytoplasmamembran ähnlich sind, gibt es Unterschiede in der Substantivität. Das Vermögen der Wirksubstanz, über längere Zeit im Mund verfügbar zu sein, sei bei CHX mit zwölf Stunden höher als bei CPC mit drei bis fünf Stunden. Dies könnte dadurch begründet werden, dass CPC nur einfach positiv geladen ist, CHX aber doppelt.
CHX ist aufgrund seiner guten antibakteriellen Eigenschaften nach wie vor Goldstandard zur Biofilmkontrolle in Deutschland (insb. komplexere Biofilme). Es wirkt gegen größere behüllte, nicht aber gegen kleinere behüllte und unbehüllte Viren. Bisher konnte nur eine sehr geringe Verminderung der Virenlast bei SARS-CoV-2 in vitro nachgewiesen werden [Meister et al. 2020]. Klinische Daten zur Verringerung der Infektiosität fehlen noch.
CPC hat ein breites Wirkungsspektrum gegen verschiedene Arten von Bakterien und Pilzen. Im Biofilm dringt CPC in tiefere Schichten vor als CHX und weist in polymikrobiellen Biofilmen eine ähnliche Effektivität auf. CPC kann die Lipidhülle von Influenza- und SARS-CoV-2-Viren in vitro zerstören. Neuere In-vitro- und In-vivo-Studien scheinen eine gute Wirkung gegen SARS-CoV-2 nachzuweisen. In vitro konnte eine Verminderung der Infektiosität um das 1000-fache sowie 100.000-fache nachgewiesen werden [Muñoz-Basagoiti et al. 2020, Statkute et al. 2020].
Effektive Bekämpfung des Biofilms
CPC scheint bei der Bekämpfung von Biofilm ähnlich effektiv wie CHX zu sein, wie eine aktuelle In-vitro-Studie zeigt [Schwarz et al. 2020]. CPC könnte dabei leichter in tiefere Biofilmschichten vordringen als CHX. Zurückzuführen sei das auf die Molekülstruktur, die geringere Größe und darauf, dass CPC im Gegensatz zu CHX nur einfach positiv geladen ist, vermutet Cieplik. „Man stelle sich den Biofilm als dreidimensionale Struktur von Bakterien eingebettet in einer Matrix aus Proteinen und Polysacchariden vor. Die Substanzen CPC und CHX müssten es also erst einmal schaffen, den Biofilm zu penetrieren.“ Das gelinge dem kleineren, positiv geladenen Molekül CPC leichter als dem doppelt positiv geladenen und größeren CHX-Molekül. Cieplik wies zudem auf die Möglichkeit der Entwicklung von bakteriellen Resistenzen gegen Antiseptika hin, deren klinische Relevanz sei aber noch Gegenstand aktueller Forschung.
Chemisches Biofilmmanagement
Seit mehr als 20 Jahren befasst sich Arweiler mit der Wirksamkeit von Mundspüllösungen im Rahmen des chemischen Biofilmmanagements. Durch den dentalen Biofilm verursachte parodontale Erkrankungen zeichneten sich durch entzündliche Veränderungen der Gingiva sowie des gesamten Zahnhalteapparats aus, unterstrich sie. Die gesundheitsökonomischen Folgekosten seien enorm. Den meisten Patienten sei nicht klar, dass Parodontitis zum Schlaganfall, Herz-Kreislauf-Störungen und Komplikationen an künstlichen Hüftgelenken führen könne. Eine neue Studie zeigt zudem: Patienten, die an Parodontitis leiden, haben auch schwerere Verläufe bei Covid-19 [Marouf et al. 2020].
- Parodontale Erkrankungen sind die am häufigsten vorkommenden Krankheiten überhaupt. Die meisten Menschen haben Defizite bei der mechanischen Reinigung.
- Chemisches Biofilmmanagement ist für Risikogruppen unerlässlich geworden. Dazu gehören laut Gingivitis-Leitlinie u. a. Personen mit eingeschränkter Alltagskompetenz, körperlichen oder geistigen Einschränkungen (z. B. Pflegebedürftige), medikamentierte Patienten (z. B. Chemotherapie / Bestrahlung) oder Patienten mit mechanisch so schwer zugänglichen Bereichen, dass kein effektives Biofilmmanagement möglich ist.
- Die Kombination der Wirkstoffe 0,05 % CHX und 0,05 % CPC verbindet eine gute antibakterielle und plaquehemmende Wirkung mit gleichzeitig weniger Nebenwirkungen. Sie bietet so eine wirksame Möglichkeit zur unterstützenden Biofilmkontrolle bei Gingivitis und im Rahmen der Nachsorge von Parodontalerkrankungen. Bei Risikopatienten auch längerfristig – individuell und nach Bedarf.
- Wichtig ist, dass die Patienten 30 bis 60 Sekunden spülen, eine App oder ein Timer kann dabei unterstützen.
Europäische Leitlinie, Anpassung auf Deutschland
Seit 2015 engagiert sich Arweiler in der Leitlinienarbeit zum chemischen und mechanischen Biofilmmanagement. Die Ansätze wurden 2020 zu einer Europäischen Leitlinie zusammengeführt und werden aktuell für Deutschland angepasst, nicht nur übersetzt, wie sie betonte. Die Überprüfung der klinischen Empfehlungen erfolge nach den Maßgaben der GRADE-ADOLOPMENT-Standards. Die S3-Leitlinie „Treatment of Stage I-III Periodontitis“ der European Federation of Periodontology (EFP) werde damit als S3-Leitlinie „Die Behandlung von Parodontitis Stadium I bis III” in Deutschland implementiert [DG PARO, DGZMK Febr. 2021, AWMF 083–043]. Detailliertere Informationen finden sich in der S3-Leitlinie „Chemisches Biofilmmanagement bei Gingivitis“ [DG PARO, DGZMK Febr. 2021, AWMF 083–016].
Die optimale häusliche Mundhygiene folge patientenindividuellen Kriterien. Zentrale Punkte seien das Entfernen der Beläge durch die mechanische Plaquekontrolle sowie die Interdentalreinigung. Antibakterielle Mundspülungen seien eine sinnvolle Ergänzung. Sowohl die Gingivitis- als auch die Parodontitis-Leitlinie empfehlen generell die Wirkstoffe CHX, CPC und ätherische Öle, vor allem zur Unterstützung bei der Entfernung des supragingivalen Biofilms (Therapiestufe 1) sowie im Rahmen der unterstützenden Parodontaltherapie (Therapiestufe 4). Die supragingivale Gabe von CHX hält Arweiler beispielsweise bei einer akuten Gingivitis für indiziert. Bei der subgingivalen Applikation, zu der die EU-Leitlinie rät, werde CHX jedoch schnell inaktiviert.
Empfehlung als Hilfsmittel in der UPT
Die häusliche mechanische Entfernung des Biofilms bildet die Grundlage der Behandlung einer gingivalen Entzündung. Ergänzende Maßnahmen, einschließlich antimikrobieller Wirkstoffe, können in bestimmten Fällen als Teil des personalisierten Therapieansatzes erwogen werden.
Wenn eine Mundspüllösung mit antibakteriellem Wirkstoff als Adjuvans bei Patienten in der unterstützenden Parodontaltherapie (UPT) eingesetzt wird, sollten Produkte gewählt werden, die Chlorhexidin, ätherische Öle oder Cetylpyridiniumchlorid enthalten.
Quelle: S3-Leitlinie „Die Behandlung von Parodontitis Stadium I bis III“ DG PARO, DGZMK Febr. 2021, AWMF 083–043
Anwendung von Mundspüllösungen (aktualisierte Leitlinie chemisches Biofilmmanagement)
Kurzfristige Anwendung 2 bis 4 Wochen (CHX-haltige Mundspüllösungen 0,1 – 0,2%):
- Vor allem bei akuter Gingivitis
- Postoperativ, in bestimmten Situationen auch als alleinige Maßnahme
Längerfristige Anwendung (niedrigere Konzentrationen ≤ 0,06 % CHX/andere Wirkstoffe):
- Bei bestimmten Personengruppen/Risikopatienten als Ergänzung der täglichen Mundhygiene
Quelle: S3-Leitlinie chemisches Biofilmmanagement bei Gingivitis, DG PARO, DGZMK Febr. 2021, AWMF 083–016
Plus der Wirkstoffkombination
Ziebolz folgt der Hypothese, dass Karies und Parodontitis opportunistische Biofilmerkrankungen sind. Vor allem in der Therapie von Gingivitis und Parodontitis haben sich neben der mechanischen Plaqueentfernung auch Antiseptika bewährt, wie von Arweiler zuvor ausgeführt (s. Leitlinienempfehlungen). CPC kann nach vorliegenden klinischen Daten (mit kurzen Beobachtungszeiten) ebenfalls zur effektiven Plaquereduktion und damit auch zur Gingivitisprävention positiv beitragen [Langa et al. 2021].
Ziebolz ging auf die Nebenwirkungsprofile von CHX und CPC ein und stellte die Vorteile der Wirkstoffkombination heraus. Vor allem ermögliche der CPC-Zusatz eine Reduktion der CHX-Konzentration bei scheinbar gleicher Effektivität, aber weniger Nebenwirkungen [Guerra et al. 2018, Quirynen et al. 2005, Escribano et al. 2010], unterstrich er. Zu den typischen CHX-Nebenwirkungen zählten etwa Verfärbungen oraler Strukturen, Geschmacksirritationen und selten Schleimhauterosionen sowie Zahnsteinbildung. Wie alle Antiseptika könnten sowohl CHX als auch CPC die Zellstruktur beeinflussen – sie wirken demnach zytotoxisch. Das ökologische Gleichgewicht der Mundhöhle dürfe nicht gestört werden, mahnte er. Insofern sehe er die Kombination als Alternative zu hochkonzentriertem CHX in der Kurzzeitanwendung.
Mundspülen in der Praxis
Fresmann beleuchtete die kontinuierliche Betreuung von Parodontitispatienten und hob die Komplexität des Krankheitsbildes hervor. „UPT ist nicht PZR“, betonte sie. Die Kombination von Anamnese, Befunde, Indices und Biofilmmangement sei das Erfolgskonzept. Dazu zählten die parodontale Befunderhebung, die Messung des Attachmentverlusts (CAL) mit sechs Messpunkten pro Zahn, der Blutungsindex BOP (Bleeding on Probing) ebenfalls an sechs Messpunkten pro Zahn, ein Plaqueindex, die Einstufung in die neue PA-Klassifikation [Tonetti et al. 2018], die geschlossene PA-Therapie sowie die risikoorientierte Frequenz der UPT auf der Basis von regelmäßig erhobenen Befunden und Indices.
Chemische Adjuvanzien seien ein ganz wichtiger Baustein der indikationsbezogenen häuslichen Mundhygiene, sagte Fresmann. Das gelte vor allem in der Nachsorge von parodontalen Behandlungen, im Rahmen der Erhaltungstherapie und in der Prävention. Entscheidend dabei sei, dass der Patient auch die 30 bis 60 Sekunden spüle. Fresmann: „Wichtig ist, dass das Praxisteam den Patienten schon während der Sitzung zur Mundhygiene instruiert und ihn motiviert, die Maßnahmen im Alltag zu integrieren. Die optimale Mundspüllösung ist dabei nebenwirkungsarm, hat einen angenehmen Geschmack und ist leicht verfügbar.“ Die Kombination aus 0,05 % CHX und 0,05% CPC (z. B. PERIO·AID Active Control) sei insbesondere bei Risikopatienten für die Nachsorge im Rahmen der UPT bis zur individuell festgelegten nächsten Dentalhygienesitzung geeignet.
Die Kombination macht’s
Die Kombination 0,05 % CHX und 0,05 % CPC (PERIO AID Active Control) vereinigt die Stärken beider Wirkstoffe und könnte somit Vorteile für folgende Anwendungsbereiche bieten:
Infektionsprophylaxe: Das Spülen vor der Behandlung (30 bis 60 Sekunden) hat sich in Praxen zum Schutz des Teams und der Patienten etabliert, um das bakterielle und ggf. auch das virale Infektionsrisiko zu reduzieren. Die Kombination von CPC und CHX deckt ein breites Spektrum an Pathogenen ab. CPC zeigt in Mundspüllösungen in vitro eine hohe antivirale Aktivität, auch gegen Corona – die Translation dieser vielversprechenden Ergebnisse in die Klinik steht aber noch aus.
Biofilmmanagement: Während CHX immer noch als Goldstandard in der Biofilmkontrolle gilt, weist auch CPC gute antibakterielle Eigenschaften auf. CPC kann gemäß Leitlinien zur Gingivitistherapie, im Rahmen der UPT sowie längerfristig nach Bedarf eingesetzt werden. In der Kombination kann durch den Zusatz von CPC die CHX-Konzentration reduziert werden, wodurch Nebenwirkungen vermindert werden können.
Die Experten

Foto: privat
Dentalhygienikerin Sylvia Fresmann
Vorsitzende der Deutschen Gesellschaft für Dentalhygieniker/Innen e.V. (DGDH), Dülmen

Foto: privat
Prof. Dr. Dirk Ziebolz
Oberarzt für Zahnerhaltung und Parodontologie am Universitätsklinikum Leipzig

Foto: privat
Virologe Dr. Dieter Hoffmann
Stellvertretender Leiter des Instituts für Virologie der Technischen Universität München

Foto: privat
Dr. Lena Katharina Müller
wissenschaftliche Mitarbeiterin der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universität Mainz

Cieplik: UKR
PD Dr. Fabian Cieplik
Oberarzt an der Poliklinik für Zahnerhaltung und Parodontologie des Universitätsklinikums Regensburg

Foto: privat
Prof. Dr. Nicole Arweiler
Direktorin der Klinik für Parodontologie und peri-implantäre Erkrankungen des UKGM der Philipps-Universität Marburg